
Rudtherford'scher Streuversuch
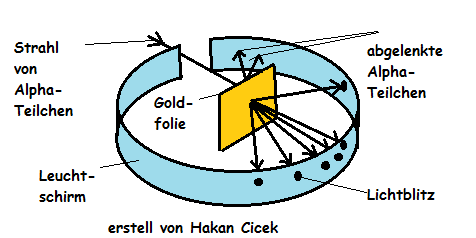
Rutherford schoss mit Alpha-Strahlen auf eine sehr dünne Goldfolie. Diese Folie besteht aus ca. 4000 Lagen Goldatomen. Hinter der Golfolie wurde ein Film aufgestellt, der sich beim Auftreffen der Alpha-Strahlung schwarz färbt.
Versuchsbeobachtungen:
Wenn Alpha-Teilchen auf eine Goldfolie geschossen werden, kommen fast alle Alpha-Teilchen ohne Ablenkung durch. Ganz selten werden Alpha-Teilchen abgelenkt oder reflektiert. Etwa 1 von 100.000 Alpha-Teilchen wird zurück- geworfen.
Versuchserklärung:
Da in einigen Fällen Alpha-Teilchen reflektiert werden, konnte Rutherford daraus schließen, dass ein undurchdringbares Objekt im Atom vorhanden sein muss. Die Tatsache , dass von 100.000 Teilchen 1 zurückgeworfen wird, verhalf Rutherford die ungefähre Größe zu bestimmen. Nämlich 100.000 mal kleiner als das Atom selbst. Aus der Ablenkung der Alpha-Teilchen schloss er außerdem, dass der Kern positiv geladen ist.
Versuchsergebnis:
Fast die gesamte Masse des Atoms befindet sich im Kern, der außerdem die gesamte positive Ladung enthält. Der Rest des Atom die Hülle ist praktisch leer. Nur die extrem kleinen Elektronen befinden sich dort.
Aus den Messergebnissen entwickelte Rutherford ein Atommodell (das Kern-Hülle-Modell). Das Kern-Hülle-Modell ist in seiner ersten Form nicht stabil, denn die Elektronen würden in den Kern stürzen wodurch keine Hülle mehr vorhanden wäre. Das Problem konnte gelöst werden durch die Annahme einer Kreisbewegung der Elektronen.
Bewegen sich die Elektronen auf einer Kreisbahn um den Kern, so heben sich die beiden Kräfte auf. Dies bezeichnet man auch als Bahnbedingung. Diese Bedingung ist für unendlich viele Bahnen erfüllt.
Rudtherford'sches Atommodell
Der britische Physiker Ernst Ruherford ( 1871 – 1937 ) entwickelte im Jahr 1911 ein sogenanntes Planetenmodell.
Seine Vorstellungen vom Atommodell waren wie folgt :
→ Um einen positiv geladenen Kern kreisen die Elektronen auf elliptische Bahnen.
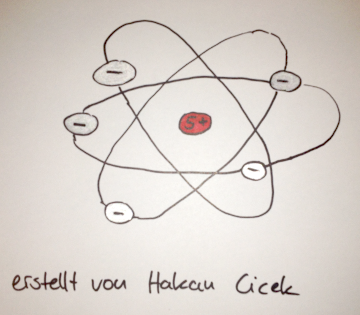
Die positiven Ladungen des Kerns und die negativen Ladungen der Elektronen kompensieren sich.
Daraus folgt: Nach außen ist das Atom neutral.
→ Fast die gesamte Masse des Atoms ist im Kern konzentriert.
→ Die Gesamtheit der Elektronen bilden die Atomhülle.
Problem!
Elektronen auf elliptischen Bahnen unterliegen der Radialbeschleunigung, d.h. die beschleunigten Ladungen senden ständig elektromagnetische Strahlung, das wiederum heißt, dass die Elektronen Energie verlieren müssten und irgendwann in den Kern stürzen. Das geschieht jedoch nicht - die Atome sind stabil!
Vorteile:
→ Die Streuversuche konnten somit erklärt werden.
→ Durch diese Annahme konnten Massen- und Ladungsverhalten im Atom erklärt werden.
Nachteile:
→ Die Entstehung der Spektrallinien konnte nicht gedeutet werden.
→ Die Stabilität des Atoms blieb ungeklärt .
Erstellt von Hakan Cicek mit kleinen Ergänzungen von Herrn Ecker 11.3.2014