
Das Atommodell von Bohr
Einleitung und Historie:
Der Däne Niels Bohr kam nach seinem Physikstudium in Kopenhagen 1911 zu J.J. Thomson, dem Entdecker des Elektrons. Im Jahr darauf ging er zu Ernest Rutherford nach Manchester. Dort hat er sich intensiv mit den Entdeckungen von Rutherford befasst. Rutherford hatte 1909 mit dem berühmten Streuversuch den Atomkern entdeckt. Die Natur der Atome war aber damals immer noch nicht vollständig geklärt. Denn man konnte mit Rutherfords Atommodell insbesondere nicht die Aussendung von Licht durch Atome erklären.
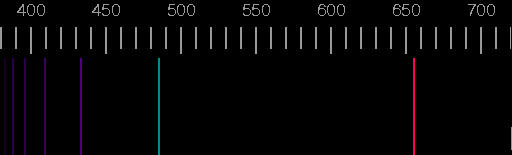
Dies hatten Gustav Kirchhoff und Robert Bunsen ab 1859 in Heidelberg entdeckt. Bei der Untersuchung der Spektren hatten sie herausgefunden, dass jedes Element ein charakteristisches Linienspektrum aussendet.
Spektrum des Wasserstoffs:
Spektrum des Natriums:
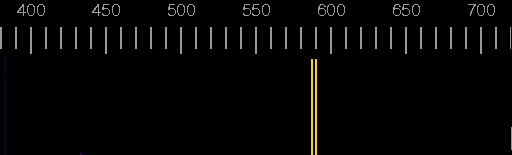
Sie konnten mit Hilfe von Spektren Stoffproben analysieren und Elemente in ihnen nachweisen (Spektralanalyse). Die charakteristischen Spektren der Atome blieben damals aber ein großes Rätsel.
Das Rätsel vergrößerte sich noch, als im Jahre 1884 der schweizer Gymnasiallehrer Johann Jakob Balmer empirisch (durch Ausprobieren) eine Formel entdeckte, mit deren Hilfe die Linien im Spektrum des Wasserstoffs berechnet werden konnten:
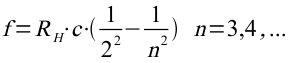
mit
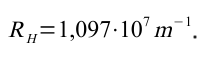
Leider konnte diese Formel nicht aus bekannten Formeln hergeleitet werden.
Im Jahre 1912 versuchte Niels Bohr diese Formel herzuleiten. Dazu ging er von Rutherfords Modell aus und hat außerdem die Erkenntnisse von Einstein bei der Erklärung des Fotoeffekts berücksichtigt. Im Jahre 1913 schlug er dann ein Modell für das Wasserstoffatom vor, das von zwei Postulaten ausgeht:
1. Das Elektron kreist nicht auf beliebigen Bahnen um den Kern, sondern nur auf Bahnen, deren Bahndrehimpuls ein ganzzahliges vielfaches des Planck`schen Wirkunsquantums ist:
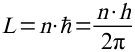
mit
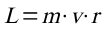
ergibt sich daraus:
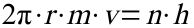
n ist dabei eine ganze Zahl. Sie wird Hauptquantenzahl genannt.
2. Beim Übergang von einer äußeren (m) auf eine innere (n) Bahn wird die Energiedifferenz der Bahnen in Form eines Photons abgegeben:
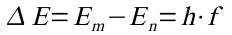
Beim umgekehrten Übergang wird ein Photon aufgenommen (absorbiert).
Mit Hilfe des ersten Postulats lassen sich die Geschwindigkeit der Elektronen und die Radien der Bahnen berechnen:
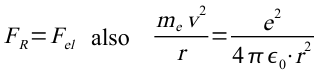
In diese Gleichung setzt man das nach dem Radius aufgelöste 1. Postulat ein und löst nach der Geschwindigkeit auf:
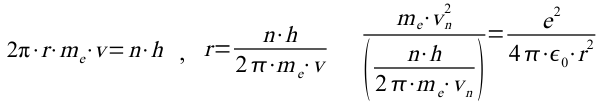
damit ergibt sich für die Geschwindigkeit auf der n-ten Bahn:
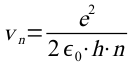
Diese Formel kann jetzt für die Berechnung des Radius verwendet werden. Mit
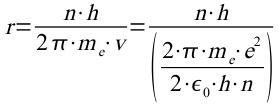
ergibt sich dann für den n-ten Bahnradius:
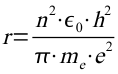
Damit man die Frequenz oder die Wellenlänge des Photons berechnen kann muss man die Energien der Bahnen kennen.
Die Bahnenergie ist:
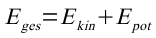
Die kinetische Energie ist:
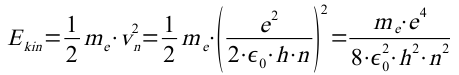
Die potentielle Energie ist:
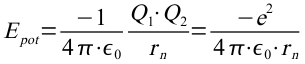
Damit ist dann die Gesamtenergie des Elektrones auf der n-ten Bahn:
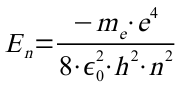
Für die 1. Bahn erhält man damit:
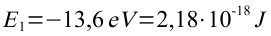
Daraus lassen sich sehr leicht die Energieen der anderen Bahnen errechnen:
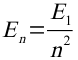
Diese Gleichung wird nun in das 2. Postulat eingesetzt und nach der Frequenz aufgelöst:
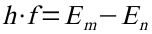
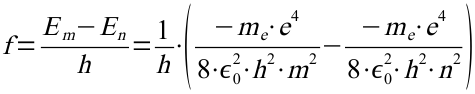
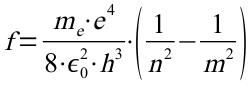
Setzt man darin n=2 ergibt sich mit den beiden folgenden Formeln:
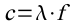
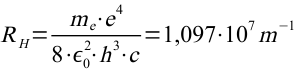
die Balmer-Formel (Die Rydbergkonstante ergibt sich dabei aus den Konstanten vor der Klammer.):
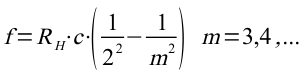
Damit konnte Bohr in beeindruckender Weise die Balmer-Formel herleiten.
Wasserstoffatom mit den Übergängen der Balmerserie:
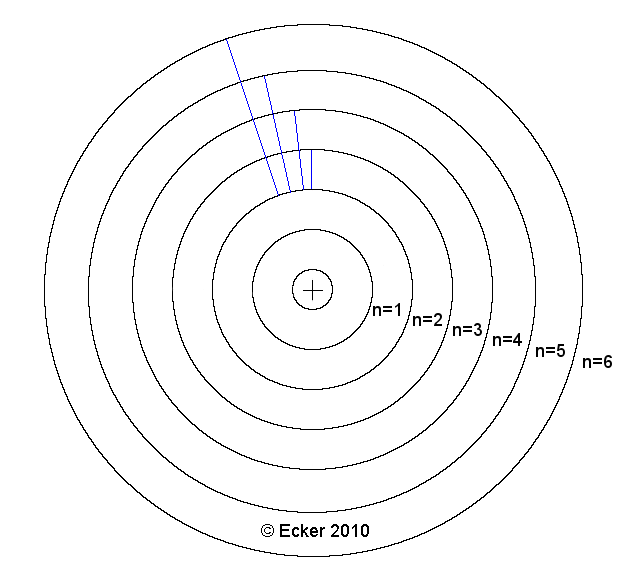
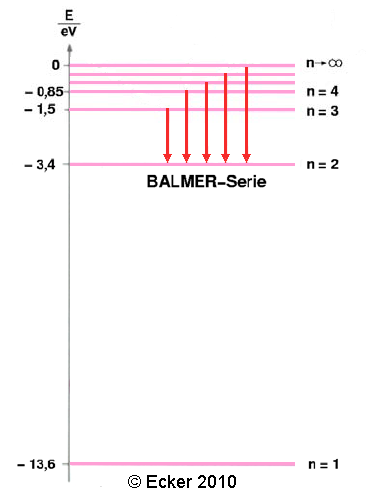
Leider hatte das Modell von Bohr auch Schwächen. Es konnte nicht die Spektren der anderen Elemente erklären und die beiden Postulate konnten auch nicht aus den bekannten physikalischen Gesetzen hergeleitet werden.
Nach der Entdeckung der Elektronenbeugung und der Unschärferelation von Werner Heisenberg war klar, dass ein neues Modell entwickelt werden musste.
R. Ecker